Généralités
Les diagrammes de phases sont des représentations, dans le plan isobare \((T, X)\) (température - composition), de la constitution physico-chimique d’un alliage dans son état thermodynamique d’équilibre. Il fournit en fonction de la température : la nature, la composition chimique et les fractions massiques des phases en présence pour un alliage de concentration déterminée. Les diagrammes de phases décrivent les équilibres \(\ce{liquide <-> solide}\) et \(\ce{solide <-> solide}\) qui régissent la solidification des alliages.
À titre d’exemple, la figure ci-dessous donne l’allure d’un diagramme de phases : il s’agit d’un diagramme fictif d’alliage binaire \(\ce{AB}\) mettant en évidence des domaines monophasés, biphasés et triphasés en accord avec la règle de Gibbs (\(v = 3 - \phi\)). Dans le cas envisagé, l’élément \(\ce{A}\) présente deux formes cristallines notées \(A_{\alpha} \)et \(A_{\alpha’}\), de même pour l’élément \(\ce{B}\) : \(B_{\beta} \)et \(B_{\beta’}\).
Le diagramme de phases présente six phases différentes :
la phase liquide (présente au dessus du liquidus, qui définit la limite au-dessus de laquelle il n’y a que du liquide)
\(\alpha\) solution solide primaire de B dans \(A_{\alpha}\)
\(\alpha’\) solution solide primaire de B dans \(A_{\alpha’}\)
\(\beta\) solution solide primaire de A dans \(B_{\beta}\)
\(\beta’\) solution solide primaire de A dans \(B_{\beta’}\)
\(\gamma\) solution solide intermédiaire
\(\ce{A_mB_n}\) composé défini
Remarquons que le solidus définit la limite en-deçà de laquelle il n’y a plus de liquide.
Les domaines \(\alpha\), \(\alpha’\), \(\beta\), \(\beta’\) et \(\gamma\) auxquels il faut ajouter la verticale du composé défini, sont monophasés. Tous les autres domaines sont biphasés mis à part les horizontales pour lesquelles trois phases sont en équilibre.
Dans les limites des domaines monophasés (\(v = 2\)), température et composition peuvent varier indépendamment sans changer la nature de la phase. Dans les domaines biphasés (\(v = 1\)), les compositions des deux phases en équilibre sont parfaitement déterminées à une température donnée. Deux règles simples permettent de déterminer les compositions, ainsi que les fractions massiques des deux phases.
La règle de l’horizontale (voir Fig. ci-après)
À la température \(T\), l’alliage \(\ce{AB}\) de composition \(X\) (% masse de \(B\)) est constitué de deux phases \(\phi_1\) et \(\phi_2\) caractérisées respectivement par des teneurs \(x \left(\phi_1 \right)\) (% masse) de \(\ce{B}\) et \(\left(100 - x \left(\phi_1 \right) \right)\) (% masse) de \(\ce{A}\) et \(x \left(\phi_2 \right)\) (% masse) de B et \(\left(100 - x \left(\phi_2 \right) \right)\) (% masse) de \(\ce{A}\). Les compositions correspondent aux abscisses des points \(M\) et \(P\) intersections de l’horizontale à la température \(T\) et des limites du domaine biphasé. La règle de l’horizontale précise donc la nature et la composition chimique des phases en équilibre à toutes les températures où le domaine biphasé existe.
La règle des segments inverses (voir Fig. ci-après)
À la température \(T\), l’alliage particulier de composition \(X\) en élément \(\ce{B}\) est caractérisé par une fraction massique des phases \(\phi_1\) et \(\phi_2\) particulière. Si \(m_1\), \(m_2\) et m sont respectivement les masses des phases \(\phi_1\) , \(\phi_2\) et de l’alliage, on a :
\(m_1 + m_2 = m\)
\(m_1.X\left(\Phi_1\right) + m_2.X\left(\Phi_2\right) = m.X\)
\(\frac{m_1}{m} = \frac{\left(X_2 - X \right)}{\left(X_2 - X_1\right)} = \frac{\bar{MN}}{\bar{PM}}\)
\(\frac{m_2}{m} = \frac{\bar{NP}}{\bar{PM}}\)
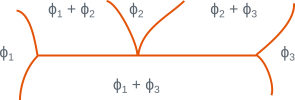
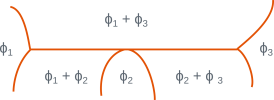
Dans les domaines triphasés pour lesquels la variance est nulle, trois phases de compositions fixées sont en équilibre à une température donnée. On ne peut pas changer la température sans que l’une des phases disparaisse. Il y a équilibre isotherme entre trois phases selon des réactions du type : \(\phi_2 <=> \phi_1 + \phi_3\). Le tableau ci-dessous donne les principales réactions isothermes en précisant les configurations des différentes phases et le type de réaction ou transformation.
Parmi les réactions citées, les transformations eutectiques et eutectoïdes ont une importance particulière car elles conduisent à des microstructures de morphologie caractéristiques (constituants eutectiques et eutectoïdes). Ces réactions sont présentes dans de nombreux diagrammes binaires, par exemple \(\ce{Fe-C}\), \(\ce{Al-Si}\), \(\ce{Cu-Zn}\), \(\ce{Pb-Sn}\).
Configuration locale du diagramme | \(\phi_1\) | \(\phi_2\) | \(\phi_3\) | Réaction ou transformation |
|---|---|---|---|---|
solide solide solide | liquide solide solide | solide solide liquide | eutectique eutectoïde | |
solide solide | liquide solide | liquide solide | monotectique monotectoïde | |
solide solide | solide solide | liquide solide | péritectique péritectoïde |