Rappel des éléments fondamentaux de thermodynamique et de cinétique pour la cristallisation
Rappelons que la grandeur clé pour décrire une cristallisation est la sursaturation[1].
La sursaturation représente l'écart à l'équilibre d'un composé chimique \(i\) pour une température et une pression données. C'est la force motrice de la cristallisation notée \(\Delta \mu_i\). \(\Delta \mu_i\) est la différence entre le potentiel chimique de l'espèce \(i\) qui cristallise dans une solution sursaturée, et celui du cristal ou du solide.
Pour un système cristallisant spontanément, on a \(\Delta \mu_i < 0\).
On peut exprimer la sursaturation sous la forme d'un rapport d'activité (voir le détail des expressions[2]) que l'on appelle rapport de sursaturation \(S\), ou d'un rapport de concentration si le rapport des coefficients d'activité tend vers 1.
On l'exprime parfois sous la forme d'une différence, on parle alors de sursaturation absolue \(\Delta C_i\).
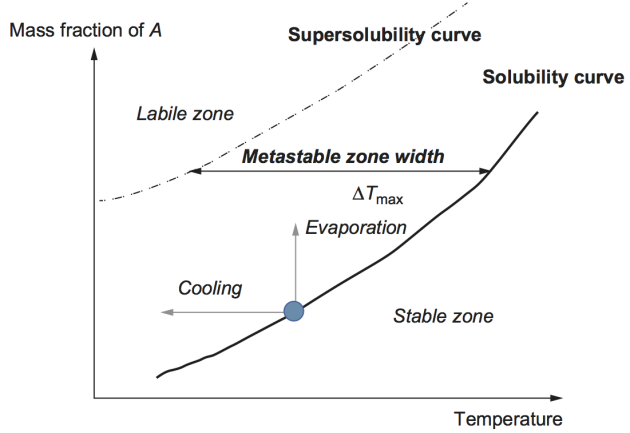
Pour qu'il y ait apparition d'un solide par cristallisation, la solution doit être en zone métastable.
À partir d'une phase liquide (une solution saturée ou sous-saturée), la cristallisation peut apparaître si l'on franchit cette zone métastable par refroidissement de la solution, par évaporation de solvant, par addition d'un anti-solvant ou par réaction chimique. Ces différentes opérations peuvent être combinées. Sur la figure suivante, les opérations de refroidissement et d'évaporation sont représentées.
Si la solution est sursaturée, elle est en conditions thermodynamiques permettant l'apparition de cristaux. Les phénomènes principaux contrôlant cette apparition sont la nucléation[4] et la croissance[5].
La nucléation est la formation des premiers embryons, correspondant à des agrégats moléculaires (voir l'approche classique[6]). Ce phénomène dépend de la probabilité de rencontres des agrégats. La théorie classique ( Mullin, 2001[7]) considère que les cristaux se forment par agrégation de clusters unitaires avec des clusters de taille supérieure (de type \(A_1 + A_{n-1} \leftrightarrows A_n\)) pour former un agrégat de taille critique appelé nucleus. Les agrégations impliquant un monomère sont plus fréquentes, notamment parce qu'ils sont plus nombreux, ce qui induit une probabilité de rencontre d'autant plus grande. Pratiquement, les clusters sont principalement des dimères et des trimères. Le taux de nucléation primaire est défini comme étant le nombre de nuclei générés par unité de volume et par unité de temps. Ce taux représente la fréquence d'apparition au temps \(t\) de super-nuclei (au delà du nucleus critique) par unité de volume.
Dès l'apparition des premiers cristaux par nucléation, ceux-ci peuvent croître. La croissance entraîne la diminution de la concentration en solution. Le phénomène de croissance[8] consiste en une étape de diffusion du soluté de la solution vers la surface du cristal, et en une étape d'intégration de cette unité de croissance à la surface du solide. Le taux de croissance du cristal est déterminé par l'étape la plus lente.
Si thermodynamiquement la sursaturation permet l'apparition de cristaux, cinétiquement les phénomènes de nucléation et de croissance vont faire apparaître les cristaux au bout d'un certain temps. Ainsi, pour caractériser la nucléation primaire, on peut mesurer le temps d'induction, qui est défini comme le temps écoulé entre la création de la sursaturation et l'apparition des cristaux. Ce temps dépend nécessairement de la méthode de mesure (et de sa précision), et reflète le temps nécessaire pour que les cristaux atteignent une taille détectable ou pour observer une diminution de la concentration en soluté (voir le détail sur le temps d'induction[9]).
La largeur de la zone métastable[10] représente la zone où la formation du solide est spontanée et incontrôlée. Elle n'est pas bien définie et dépend fortement des conditions opératoires, notamment de la vitesse à laquelle la sursaturation a été créée, et de la présence de cristaux en solution.