Retour sur le comportement d'un fluide pur
Le comportement réel des fluides purs peut être reporté sous la forme d'isothermes de Clapeyron : \[P\] en fonction du volume molaire \[v\] à température constant.
Ce diagramme montre l'existence d'une température critique[3] \[{T}_{c}\], en-dessous de laquelle les isothermes présentent un palier à pression constante correspondant au changement de phase liquide-vapeur. L'ordonnée de ce pallier est bien sûr la pression de saturation correspondant à la température de l'isotherme.
Au-dessus de la température critique[3], il n'y a plus de distinction possible entre liquide et vapeur. Il est possible de passer d'un état clairement identifié comme liquide (à une température sous-critique[3]) à un état vapeur à la même température en "contournant" le point critique[3] : on aura alors réalisé un changement de phase sans que jamais voir de transition de phase (pas d'interface liquide-gaz)
Le point critique[3], sommet du dôme diphasique, apparaît donc comme la situation où le liquide et la vapeur à l'équilibre sont strictement identiques. Il existe pour tous les fluides, même si ses coordonnées varient beaucoup d'un fluide à l'autre. (voir le tableau suivant)
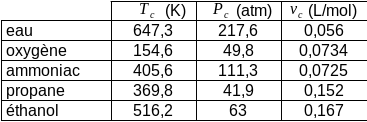
C'est ce comportement des fluides réels, qui montre une continuité entre les états liquide et vapeur, que nous cherchons à représenter analytiquement.